Come l’UE protegge i pazienti
 Mentre lo Stato italiano sponsorizza test clinici su bambini pur senza solidi dati pre-clinici, l’Unione Europea si preoccupa di rafforzare le tutele a favore di chi viene reclutato in un test clinico, di rendere i dati sulle sperimentazioni più trasparenti e di fornire informazioni corrette a medici e pazienti.
Mentre lo Stato italiano sponsorizza test clinici su bambini pur senza solidi dati pre-clinici, l’Unione Europea si preoccupa di rafforzare le tutele a favore di chi viene reclutato in un test clinico, di rendere i dati sulle sperimentazioni più trasparenti e di fornire informazioni corrette a medici e pazienti.
La settimana scorsa, la Commisione di Sanità Pubblica del Parlamento Europeo ha ascoltato le ragioni di Glenis Willmott (Laborista – UK) che ha proposto dettagliati cambiamenti all’attuale regolazione sui test clinici, che, a dire di osservatori internazionali, erano quanto meno urgenti.
Perché, c’era un problema?
Una cosa è certa: medici e pazienti necessitano di tutte le informazioni possibili riguardanti un farmaco per poter scegliere la cura migliore. Ma quanto è efficace la pillola A rispetto alla B? Di 100 persone che hanno usufruito della cura, quante sono guarite?
Tutte queste informazioni sono attualmente tenute sotto chiave in due posti: dalle industrie farmaceutiche che conducono i test clinici per commercializzare i loro prodotti, e dalle agenzie di regolazione del farmaco, come la EMA in Europa.
Le aziende farmaceutiche investono molto denaro in ricerca e sviluppo per nuovi farmaci in paragone ad altre aziende: più del 15% delle loro vendite torna in R&D. Questo numero è spesso minimizzato dal fatto che queste aziende spendano molto di più in marketing (ed è vero), ma se messi in prospettiva con altre imprese, fanno meglio della Apple, IBM e Google.
Lo sviluppo di nuovi farmaci parte dalla provetta in laboratorio, passa dai test tossicologici ed arriva al test clinico.
Il test clinico è vecchio quanto la Bibbia (Daniele 1:11) e incredibilmente semplice: in sostanza un gruppo di volontari viene diviso a metà e ad alcuni viene data una semplice pillola senza principio attivo (placebo), mentre agli altri viene dato il prodotto farmaceutico da testare. Se il secondo gruppo mostrerà effetti migliori del primo, il farmaco avrà ragione di essere commercializzato.
La situazione attuale
L’attuale legislazione permette a chiunque faccia test clinici (industria o accademia) di tenerli nascosti se i suoi risultati non piacciono allo sponsor. Questo problema, ben noto ai ricercatori, è chiamato publication bias: gli esperimenti con risultati negativi (dove l’ipotesi non è supportata) vengono lasciati nel cassetto. La pillola A non mostra effetti migliori del placebo? Meglio dimenticarci di questo test e farne un’altro. C’é dunque il rischio/tentazione di condurre 10 esperimenti e di presentare solo quei cinque che sembrano darci ragione.
Se rivelassi solo la metà dei risultati che ottengono dal lancio di una moneta, potrei facilmente convincere chiunque che essa abbia ‘testa’ su entrambi i lati.
Studi clinici non pubblicati sono un problema riconosciuto e documentato. Nel 2010, l’Autorità Sanitaria Nazionale Inglese (NHS) pubblica un (lungo) documento che indica come la metà di tutti i test clinici condotti non siano mai stati pubblicati su giornali accademici. Alcuni test non sono neppure registrati nei database, e quei trials con risultati accondiscendenti hanno il doppio delle possibilità di essere pubblicati rispetto agli altri.
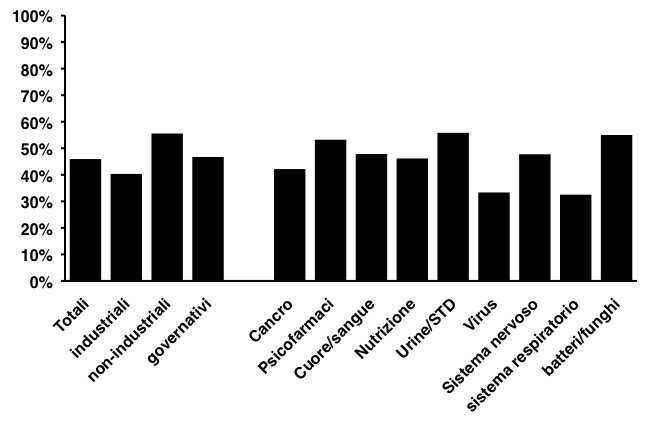
Proporzione di test clinici registrati su ClinicalTrials.gov e pubblicati su giornali accademici. Il problema riguarda sia test clinici sponsorizzati o meno dall’industria e contamina tutti i settori della medicina
Adattato da PLoS Medicine (2009 Sep 8;6:e1000144)
Ai medici di fatto viene fatta vedere solo la letteratura scientifica a supporto di un prodotto, e non avendo in mano l’intero quadro della situazione, ai pazienti vengono prescritti farmaci meno efficaci o più costosi di altre opzioni disponibili.
I cambiamenti
Ma le cose stanno per cambiare: ecco le contromisure che la Commissione Salute ha approvato all’unanimità, e che l’intero parlamento Europeo voterà tra poche settimane:
-
Riduzione della burocrazia necessaria per iniziare un test clinico. In Europa, sostiene la Willmott, i test clinici sono scesi del 25% in 5 anni. Ridurne la burocrazia significa promuovere questo essenziale passaggio per l’arrivo di nuove cure.
-
Creazione di un database di pubblico dominio per la registrazione obbligatoria di tutti i test clinici. I test dovranno essere registrati al momento della loro creazione e prima che si inizino, cosí da eliminare i “test fantasma” (1).
-
I risultati (più importanti) dei test dovranno essere pubblicati in meno di un anno dalla loro conclusione
-
Il Rapporto sul Test Clinico (Clinical Study Report) dovrà essere pubblicato per intero una volta che il medicinale, il metodo diagnostico o la profilassi sia stata apporvata. Il Rapporto sul Test Clinico è il documento più importante: mostra tutti i numeri ed i dettagli del test, il protocollo, i criteri per reclutare i pazienti, i metodi statistici utilizzati, ecc… (2)
-
Multe verranno introdotte se tutto questo non verrà adempiuto.
La petizione
 Motore indiscusso di questi cambiamenti è l’iniziativa AllTrials, che mira a sensibilizzare il pubblico sulla gravità del publication bias in farmaceutica ed in generale nella pratica medica. AllTrials è organizzata da importanti nomi della scienza medica Europea, tra cui Bad Science, Sense About Science, British Medical Journal, James Lind Initiative ed il Centre for Evidence-based Medicine. L’hashtag #alltrials su twitter è particolarmente vivo in queste settimane.
Motore indiscusso di questi cambiamenti è l’iniziativa AllTrials, che mira a sensibilizzare il pubblico sulla gravità del publication bias in farmaceutica ed in generale nella pratica medica. AllTrials è organizzata da importanti nomi della scienza medica Europea, tra cui Bad Science, Sense About Science, British Medical Journal, James Lind Initiative ed il Centre for Evidence-based Medicine. L’hashtag #alltrials su twitter è particolarmente vivo in queste settimane.
La petizione può essere firmata qui. Sottoscrivi la petizione e convinci amici, parenti e colleghi a fare altrettanto se pensi che medici e pazienti abbiano il diritto di scegliere il proprio trattamento farmacologico basandosi su tutte le prove scientifiche disponibili.
(1) Per completezza di informazione, alla EMA è stato chiesto di organizzare un database del genere già nel 2001, ma questo strumento di trasparenza è rimasto inaccessibile al pubblico. Da allora, nel 2009, 2011 e 2012 la EMA ha ripetutamente dichiarato di averne aperto l’accesso, ma diverse migliaia di dati ancora mancano, compresi i dati sui test clinici di fase 1.
(2) Per intenderci, questo sarà il documento chiave (che non vedo l’ora di leggere) per la sperimentazione Stamina in Italia.






