I dubbi di Davide
Il Prof. Davide Vannoni ha recentemente commentato la ricerca di Naldini pubblicata su Science, dove il team di ricercatori riporta con successo due terapie geniche usate per correggere malattie degenerative del sistema immunitario.
La ricerca è stata pubblicata in due distinti articoli per un totale di sei bambini a stadi pre-sintomatici delle malattie di Wiskott-Aldrich e leucodistrofia metacromatica. Entrambe queste sindromi risultano da un singolo, ben identificato, gene non funzionante che gioca un ruolo essenziale nella creazione delle difese dell’organismo.
Le cellule del sistema immunitario di questi bambini sono difettose e bisogna cambiarle.
Un riassunto in video di quello che i ricercatori hanno fatto è disponibile qui.
Ad oggi, l’80% delle malattie rare è dovuta a difetti genetici, per più di 5.000 sindromi diverse. Per decenni scienziati hanno esplorato la possibilità di intervenire direttamente sul materiale genetico ed inserire copie corrette di questi geni, e gli studi di Naldini ci aiutano a capire i rischi ed i benefici di queste manipolazioni.
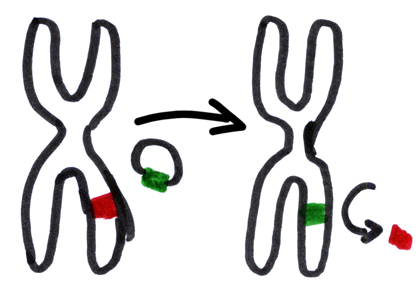
Terapia Genetica. Da anni i ricercatori cercano di rimpiazzare copie non funzionanti di geni (in rosso) con copie funzionanti (in verde).
Un metodo prevede l’utilizzo di virus resi innocui (circoletto nella figura) che trasportino la copia del gene giusta.
Dopo aver letto l’articolo, Vannoni si cimenta in una considerazione tecnica che lo lascia dubbioso:
Quello che non riesco a capire della tecnica di Naldini è questo, visto che le cellule staminali sono perfettamente compatibili da un individuo ad un altro (non esprimono l’HLA2) che bisogno c’è di prendere delle cellule staminali dal paziente, inserirgli con un retrovirus il gene da sostituire, poi fare una ablazione del sistema immunitario del paziente (????) per poi reiniettare queste staminali geneticamente modificate facendo in modo che cedano la proteina o l’enzima mancante. Perchè non inserire direttamente cellule staminali da un donatore sano?
I punti interrogativi sono suoi.
Considerando che in questi giorni Vannoni si accinge a consegnare i suoi protocolli alla commissione dell’ISS per iniziare a spendere i 3 milioni di euro messi a disposizione per la sperimentazione, mi sento in dovere di aiutarlo a dipanare questi suoi interrogativi che riguardano l’ABC del trapianto di cellule staminali.
Primo dubbio: perché non inserire direttamente cellule staminali da un donatore sano?
Naldini et. al. hanno praticato qualcosa di simile ad un trapianto di midollo. Questa pratica conta 20.000 pazienti all’anno solo in America, e vanta centinaia di studi che ne hanno comprovato i limiti, i rischi ed i benefici. Nel trapianto di midollo, il sistema immunitario di un paziente viene prima ‘ripulito’ con l’utilizzo di farmaci, e poi sostituito da un nuovo sistema immunitario. Nella maggior parte dei casi, queste difese nuove di zecca arrivano dalle cellule staminali emopoietiche (CSE) di un donatore.
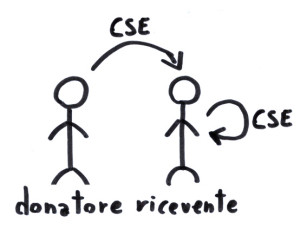
Trapianto di midollo. In questa tecnologia, delle cellule staminali emopoietiche (CSE) vengono iniettate nel corpo di un paziente (ricevente). Queste cellule possono arrivare da un donatore compatibile (trapianto allogenico) o possono derivare dal paziente stesso (trapianto singenico), come nel caso della ricerca di Nadini
Ma il metodo ha i suoi limiti. Uno di questi è la necessità che il donatore ed il ricevente siano compatibili, similmente ad un donatore di sangue che deve essere dello stesso gruppo sanguigno di colui che riceve la trasfusione. Anche per questo motivo, lo scambio di cellule staminali emopoietiche avviene preferibilmente tra consanguinei.
Come specificato dai ricercatori, in certi casi un donatore non c’é. Almeno nel caso dei bambini affetti da leucodistrofia metacromatica, infatti, la malattia si è sviluppata prima nei fratelli maggiori, il che ha permesso di rintracciare nei minori lo stesso difetto genetico. Considerando la situazione, è plausibile che sia il trapianto singenico (usando cellule dello stesso bambino corrette geneticamente) la soluzione che il team di Naldini ha deciso di percorrere.
Secondo dubbio: visto che le cellule staminali sono perfettamente compatibili da un individuo ad un altro (non esprimono l’HLA2) perché non prendere staminali da un donatore sano?*
Purtroppo non è così. Nessuna cellula emopoietica staminale è mai totalmente compatibile tra un individuo e l’altro, eccetto (forse) per gemelli omozigoti. Se così fosse, perché darsi tanto da fare nel cercare donatori di midollo osseo compatibili con i pazienti?
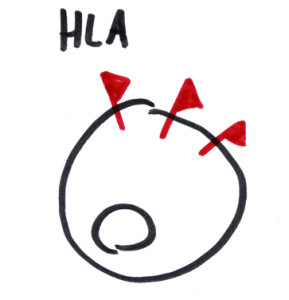
Il riferimento “non esprimono l’HLA2” poi è fuorviante. Le proteine HLA sono delle piccole ‘bandierine’ piantate sulla superficie di tutte le cellule del corpo, che il sistema immunitario usa per riconoscere cosa attaccare e cosa no.
Come funzionano? Quando nuove cellule arrivano dentro un paziente, si portano dietro le loro bandiere HLA. Se queste sono diverse da quelle del ricevente (il paziente) ci sarà una gran zuffa: un po’ come quando dei tifosi ad una partita di calcio finiscono nella curva della squadra avversaria, adornati con i loro colori di bandiera. Questa ‘lotta’ tra cellule del donatore e del ricevente può avere due conseguenze: se la squadra locale vince (Host vs Graft rejection) le nuove cellule sono distrutte e si riparte da capo. Se la squadra locale perde (Graft vs Host disease) il nuovo sistema immunitario prende il sopravvento, iniziando ad attaccare gli organi del ricevente. Entrambi sono casi indesiderati.
Per queste ragioni, le cellule staminali emopoietiche non sono tutte uguali tra di loro. Al contrario, il donatore dovrà avere delle bandiere HLA molto simili a quelle del ricevente se non si vuole accendere la miccia! Se si pianificasse di prendere cellule staminali da un passante (sano) per trasferirle dentro un paziente con un trapianto di midollo, si potrebbe incappare nello stesso effetto collaterale riscontrato nei pazienti che in passato sono stati vittima di questa svista: la morte.
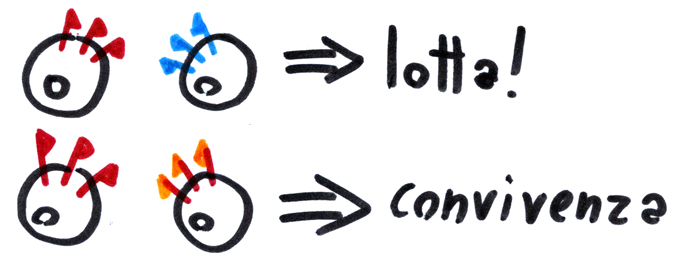
Lotta tra tifosi. Se cellule staminali di donatore e ricevente hanno profili HLA molto diversi, si rishiano pericolosi effetti collaterali. Al contrario, se il profilo HLA è simile (anche non identico) il trapianto ha più possibilità di funzionare.
Per far capire quanto le ‘bandiere HLA’ siano rilevanti in materia, riporto la prima frase, del primo paragrafo, di una recente review su Bone Marrow Research (M Park & JJ Seo, 2012):
“The selection of hematopoietic stem cell transplantation (HSCT) donors includes a rigorous assessment of the availability and human leukocyte antigen (HLA) match status of donors”
Vannoni dice: visto che le staminali non hanno HLA2 (immagino si riferisca alle HLA di Classe II), allora il problema non sussiste. L’idea è che senza bandiere HLA, le cellule possano intrufolarsi dove vogliono senza essere scoperte. Certo, questo se le staminali rimanessero staminali per sempre. Ma come i brevetti dello stesso Vannoni mostrano, almeno sulla carta, queste cambiano, maturano e diventano altre cellule che servono a riparare parti del nostro corpo.
Le staminali emopoietiche quando trovano casa, cominciano a trasformarsi in cellule come i linfociti, che sono dei veri e propri ultras del sistema immunitario, con una batteria di bandiere talmente in vista da far infuriare l’intera tifoseria della squadra locale.
Terzo dubbio: Che bisogno c’era di fare una ablazione del sistema immunitario del paziente prima di re-iniettargli le staminali modificate geneticamente?
Il principio si chiama engraftment e consiste nel creare spazio alle nuove cellule iniettate nel paziente affinché prendano il posto delle vecchie. Il fenomeno è incredibilmente documentato in letteratura medica [qui, qui, qui, qui ed una buona review è qui].
Nel caso di Naldini, i ricercatori sanno bene che se non riducono momentaneamente il sistema immunitario del paziente, le nuove cellule non riusciranno mai a prendere il posto [o supportare] quelle attualmente in circolazione. In particolare, come indicato nei Metodi del lavoro, i ricercatori si rifanno all’esperienza acquisita in altri due studi clinici che mostrano come la riduzione del sistema immunitario sia necessaria affinché le nuove cellule trovino casa.
Passare attraverso questa immunodepressione non è cosa da poco. Il corpo certamente ne risente, ma se il donatore delle cellule fosse stato un fratello (“donatore sano” come suggerisce(?) Vannoni) i bambini avrebbero attraversato un regime farmacologico più aggressivo e più dannoso, come specificato nella sezione M&M dell’articolo.
Con l’augurio di aver contribuito a risolvere i dubbi tecnici che il professor Vannoni ha riscontrato nella lettura dell’articolo di Science.
D.F.T.B.A.
———————
*È possibile anche che su questo punto Vannoni stia facendo confusione tra cellule staminali mesenchimali (MSC – le cellule alla base del “metodo” Stamina) e cellule staminali emopoietiche. C’é differenza: le MSC non diventano cellule del sistema immunitario, mentre cellule staminali emopoietiche si, e sono queste che vanno usate per curare questi bambini.